Principio del experimento
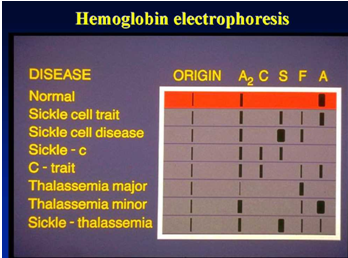
La electroforesis de hemoglobina tiene como objetivo detectar y confirmar varias hemoglobinas normales y anormales.
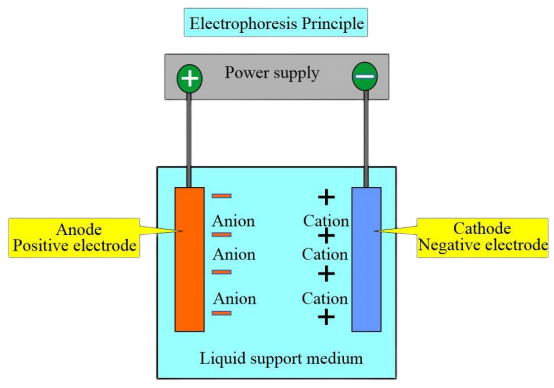
Debido a las diferentes cargas y puntos isoeléctricos de los diferentes tipos de hemoglobina, en una determinada solución tampón de pH, cuando el punto isoeléctrico de la hemoglobina es inferior al pH de la solución tampón, la hemoglobina lleva una carga negativa y migra hacia el ánodo durante la electroforesis. Por el contrario, la hemoglobina con carga positiva se mueve hacia el cátodo.
Bajo un cierto voltaje y después de un tiempo de electroforesis específico, las hemoglobinas con diferentes cargas y pesos moleculares exhiben diferentes direcciones y velocidades de migración. Esto permite la separación de zonas distintas y se puede realizar un análisis de escaneo colorimétrico o electroforético posterior en estas zonas para cuantificar varias hemoglobinas. El método más utilizado es la electroforesis en membrana de acetato de celulosa con pH 8,6.
Dentro del citoplasma, los grupos de etilenglicol (CHOH-CHOH) presentes en el glucógeno o sustancias polisacáridas (como mucopolisacáridos, mucoproteínas, glicoproteínas, glicolípidos, etc.) son oxidados por el ácido periódico y convertidos en grupos aldehído (CHO-CHO). Estos grupos aldehídos se combinan con el reactivo de Schiff incoloro de color rojo violáceo, formando un tinte rojo púrpura que se deposita donde están presentes los polisacáridos en la célula. Esta reacción se conoce como tinción con ácido periódico de Schiff (PAS), anteriormente denominada tinción de glucógeno.
Método de experimento
Materiales:acetato de celulosamembrana, aparato de electroforesis(DYCP-38C y fuente de alimentación DYY-6C), Herramienta de carga de muestras superior (pipeta), espectrofotómetro, cubetas colorimétricas, amortiguadores.
Buffer:
(1) Tampón TEB de pH 8,6: pesar 10,29 g de Tris, 0,6 g de EDTA, 3,2 g de ácido bórico y añadir agua destilada hasta 1000 ml.
(2) Tampón de borato: Pesar 6,87 g de bórax y 5,56 g de ácido bórico y añadir agua destilada hasta 1000 ml.
Procedimiento:
Preparación de la solución de hemoglobina
Tome 3 ml de sangre que contenga heparina o citrato de sodio como anticoagulante. Centrifugar a 2000 rpm durante 10 minutos y desechar el plasma. Lavar los glóbulos rojos tres veces con solución salina fisiológica (750 rpm, 5 minutos de centrifugación cada vez). Centrifugar a 2200 rpm durante 10 minutos y desechar el sobrenadante. Agregue una cantidad igual de agua destilada, luego agregue 0,5 veces el volumen de tetracloruro de carbono. Agite vigorosamente durante 5 minutos y luego centrifugue a 2200 rpm durante 10 minutos para recoger la solución de Hb superior para su uso posterior.
Remojar la membrana
Cortar la membrana de acetato de celulosa en tiras de 3 cm × 8 cm. Remójelos en tampón TEB de pH 8,6 hasta que estén completamente saturados, luego retírelos y séquelos con papel de filtro.
Punteo
Utilice una pipeta para colocar 10 l de la solución de hemoglobina verticalmente sobre la membrana de acetato de celulosa (el lado rugoso), aproximadamente a 1,5 cm del borde.
Electroforesis
Vierta la solución tampón de borato en la cámara de electroforesis. Coloque la membrana de acetato de celulosa con el lado manchado en el extremo del cátodo de la cámara. Ejecute a 200 V durante 30 minutos.
elución
Recorte las zonas de HbA y HbA2, colóquelas en tubos de ensayo separados y agregue 15 ml y 3 ml de agua destilada, respectivamente. Agite suavemente para eluir completamente la hemoglobina y luego mezcle..
colorimetria
Ponga a cero la absorbancia usando agua destilada para la solución de elución y mida la absorbancia a 415 nm.
Cálculo
HbA2(%) = Absorbancia del tubo de HbA2 / (Absorbancia del tubo de HbA × 5 + Absorbancia del tubo de HbA2) × 100%
Cálculo de resultados experimentales
Rango de referencia para electroforesis de acetato de celulosa con tampón TEB de pH 8,6: HbA > 95 %, HbA2 1 %-3,1 %
Notas
El tiempo de electroforesis no debe ser demasiado largo. La membrana de acetato de celulosa no debe secarse durante la electroforesis. Detenga la electroforesis cuando HbA y HbA2 estén claramente separados. La electroforesis prolongada puede provocar difusión y borrosidad de las bandas.
Evite utilizar demasiada muestra. Un exceso de hemoglobina líquida puede provocar el desprendimiento de la banda o una tinción insuficiente, lo que da como resultado niveles de HbA1c falsamente elevados.
Prevenir la contaminación de la membrana de acetato de celulosa con proteínas.
La corriente no debe ser demasiado alta; de lo contrario, es posible que las bandas de hemoglobina no se separen.
Incluya siempre muestras de individuos normales y hemoglobinas anormales conocidas necesarias como controles.
Beijing Liuyi Biotechnology fabrica el tanque de electroforesis profesional para electroforesis de hemoglobina que es el modeloDYCP-38Ctanque de electroforesis de membrana de acetato de celulosa, y hay dos modelos de fuente de alimentación de electroforesis disponibles para el tanque de electroforesis de membrana de acetato de celulosaDYY-2CyDYY-6Cfuente de alimentación.
Mientras tanto, Beijing Liuyi Biotechnology proporciona membranas de acetato de celulosa a sus clientes y el tamaño de la membrana de acetato de celulosa se puede personalizar. Bienvenido a solicitarnos muestras y más información.
La marca Beijing Liuyi tiene más de 50 años de historia en China y la empresa puede ofrecer productos estables y de alta calidad en todo el mundo. ¡A través de años de desarrollo, es digno de su elección!
Ahora estamos buscando socios, tanto el tanque de electroforesis OEM como los distribuidores son bienvenidos.
Si tiene algún plan de compra para nuestros productos, no dude en contactarnos. Puedes enviarnos un mensaje al correo electrónico.[correo electrónico protegido]o[correo electrónico protegido], o llámenos al +86 15810650221 o agregue Whatsapp +86 15810650221, o Wechat: 15810650221
Hora de publicación: 20-sep-2023